Según la hipótesis de los ‘viejos amigos’, las prácticas de higiene y el uso de antibióticos habrían alterado nuestro entorno microbiológico de modo que la exposición insuficiente a microorganismos que ancestralmente nos habrían colonizado impediría la expansión adecuada de los mecanismos de regulación inmunitaria, incrementándose así la incidencia de enfermedades inmunoinflamatorias.
En Septiembre de 2002, el pediatra francés Jean-Françoise Bach publicó en la revista New England Journal of Medicine un artículo de revisión1 sobre mecanismos de enfermedad en el que básicamente se propone que la falta de exposición al mundo microbiano puede estar en el origen del aumento de enfermedades crónicas no transmisibles de base inmunológica, como las atopias, el asma, las enfermedades inflamatorias del intestino, la esclerosis múltiple, etc. La iconografía del artículo se hizo rápidamente famosa en todo el mundo (figura 1):
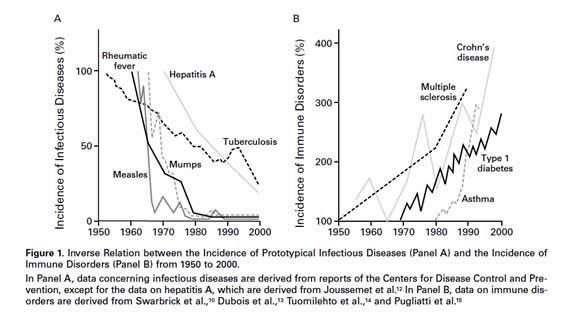
La casi desaparición de las grandes plagas infecciosas coincide temporalmente con la introducción de los antibióticos (y las vacunas), y da lugar a un cambio de ciclo en patología humana, con un incremento desproporcionado de enfermedades inmunoinflamatorias no transmisibles. Aunque inicialmente se propuso que la falta de infecciones podía estar desequilibrando el sistema inmune, el descubrimiento en modelos murinos de estirpes de linfocitos T reguladores (Tregs), mediadores de tolerancia y con actividad antiinflamatoria, abrió un nuevo escenario: el rol del contacto con microorganismos no patógenos en la generación de mecanismos reguladores del sistema inmunitario. Las prácticas de higiene y el uso de antibióticos habrían alterado nuestro entorno microbiológico de modo que la exposición insuficiente a ‘viejos amigos’, nuestros colonizadores ancestrales, impediría la expansión adecuada de los mecanismos de regulación inmunitaria, incrementándose así la incidencia de enfermedades inmunoinflamatorias2.
Esta nueva perspectiva encaja muy bien con las observaciones epidemiológicas (en países con bajo desarrollo social no se ha desencadenado la epidemia de enfermedades inmunoinflamatorias) y ha sido ampliamente aceptada como hipótesis, pero no se han podido comprobar todos los aspectos mecanísticos de la hipótesis. Concretamente, es patente que diversos microorganismos comensales inducen la expansión de Tregs en el ratón3, pero hay pocos datos que lo demuestren en el ser humano, y no es evidente que el defecto de Tregs juegue un papel en los pacientes que sufren patologías inmunoinflamatorias.
Una línea de investigación reciente aporta nuevas luces que soportan la plausibilidad de la hipótesis de los ‘viejos amigos’4. Se ha identificado en el ser humano una nueva estirpe de linfocitos Tregs (CD4CD8aa), hasta ahora desconocida, que tiene características fenotípicas distintas de las descritas en el ratón (no expresan foxp3), pero desarrollan clara actividad antiinflamatoria e inmunorreguladora. Estás células se inducen tanto in vivo como in vitro por contacto con comensales de la microbiota intestinal dominante en el humano (Faecalibacterium prausnitzii), están presentes en la lámina propia intestinal, y también en sangre periférica (expresan receptores de alojamiento intestinal). Es importante destacar que los pacientes con enfermedad inflamatoria intestinal (enfermedad de Crohn o colitis ulcerosa) muestran defecto de CD4CD8aa tanto en la lámina propia intestinal como en sangre periférica.
Estos hallazgos son prometedores y trascendentes. No solo contribuyen a entender la fisiopatología de los trastornos inmunoinflamatorios, sino que permitirán optimizar el uso de probióticos para la prevención o el tratamiento de atopias (dermatitis, asma), patología inflamatoria intestinal, etc. Contamos ahora con un marcador útil, el nivel de linfocitos CD4CD8aa, para evaluar la potencia y posible eficacia de los probióticos en dichas patologías.
Bibliografía
- Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med. 2002; 347(12): 911-20.
- Guarner F, Bourdet-Sicard R, Brandtzaeg P et al. Mechanisms of disease: the hygiene hypothesis revisited. Nat Clin Pract Gastroenterol Hepatol. 2006; 3(5): 275-84.
- Atarashi K, Tanoue T, Shima T et al. Induction of colonic regulatory T cells by indigenous Clostridium species. Science. 2011; 331(6015): 337-41.
- Sarrabayrouse G, Bossard C, Chauvin JM et al. CD4CD8αα lymphocytes, a novel human regulatory T cell subset induced by colonic bacteria and deficient in patients with inflammatory bowel disease. PLoS Biol. 2014; 12(4): e1001833.



Buenas tardes; desearía saber qué probióticos se puede utilizar como coadyuvante al tratamiento convencional en una enfermedad autoinmune, regularizar el sistema inmunitario, por PAN de causa desconocida. Gracias.
No hay datos en PAN, pero hay datos en controles sanos se vio que el consumo regular de Bifidobacterium infantis 35624 (de venta en España como Alflorex), incrementa la presencia de linfocitos reguladores Treg Foxp3+ en sangre periférica y la producción de IL-10 (Koniecza et al, Gut 2012). Es plausible que haya un efecto anti-inflamatorio en tratamientos prolongados.
Perdone mi duda Dr.; pero ud. cree que se podría tomar Alflorex, al tener tratamiento con Metotrexato?, la causa de la PAN es idiopática se lo puedo asegurar. Muchas gracias por su respuesta.
No veo ningún riesgo ni efectos secundarios previsibles en tratamiento prolongado con Bifidobacterium infantes 35624 (Alflorex), junto al tratamiento inmuinosupresor con Metrotrexato. No se han descrito infecciones oportunistas ni de ningún tipo con bifiídobacterias a pesar de que es un germen presente en el intestino de todos los humanos. Y concretamente con la cepa B. infantis 35624 nunca ha habido infecciones aun con dosis altas. No veo riesgos en un tratamiento prolongado. Tampoco está claro que vaya a haber beneficios, pero en todo caso, recomiendo un tratamiento largo de al menos 12 semanas. Si hay efecto favorable, sería a largo plazo.
Muchas gracias, doctor; ya le contaré que tal?. Que pase una buena tarde.